Определение микробиологической безопасности почвы
Микробиологические исследования и оценка санитарного состояния почв и грунтов
 Биологическое загрязнение почв и грунтов – это накопление в почвах и грунтах возбудителей инфекционных и инвазионных болезней, а также насекомых и клещей, переносчиков возбудителей болезней человека, животных и растений в количествах, представляющих потенциальную опасность для здоровья человека, животных, растений.
Биологическое загрязнение почв и грунтов – это накопление в почвах и грунтах возбудителей инфекционных и инвазионных болезней, а также насекомых и клещей, переносчиков возбудителей болезней человека, животных и растений в количествах, представляющих потенциальную опасность для здоровья человека, животных, растений.
В почве встречаются все формы микроорганизмов которые есть на Земле: бактерии, вирусы, актиномицеты, дрожжи, грибы, простейшие, растения. Общее микробное число в 1 г почвы может достигать 1–5 млрд. Наибольшее количество микроорганизмов встречается в самых верхних слоях (1-2-5 см), а в отдельных почвах они распространены до глубины 30-40 см.
Контролю с применением санитарно-микробиологических исследований (бактериологический, гельминтологический или паразитарный, энтомологический анализы) подлежат почвы и грунты территорий детских и лечебно-профилактических учреждений, сельских поселений, не канализованных районов городских населенных пунктов, территории первого пояса зоны санитарной охраны источников хозяйственно-питьевого водоснабжения, зоны свалок, отвальных площадок, а так же сельскохозяйственные поля, орошаемые водой из открытых водоемов, городскими промышленными стоками, стоками животноводческих ферм, удобряемые навозом, территории строительства.
Санитарное состояние почвы — совокупность физико-химических и биологических свойств почвы, определяющих качество и степень ее безопасности в эпидемическом и гигиеническом отношениях. В соответствии с требованиями МУ 2.1.7.730 « Гигиеническая оценка качества почвы населенных мест», СанПиН 2.1.7.1287-03 «Санитарно-эпидемиологические требования к качеству почвы» оценка санитарного состояния основывается на результатах лабораторных анализов по санитарно-бактериологическим, санитарно-гельминтологическим (паразитарным), санитарно-энтомологическим показателям.
Санитарно-бактериологический анализ для оценки санитарного состояния почв включает определение обязательных показателей:
- Индекс бактерий группы кишечной палочки (индекс БГКП);
- Индекс энтерококков (фекальные стрептококки);
- Патогенные бактерии (патогенные энтеробактерии, в т.ч. сальмонеллы, энтеровирусы).
Эти бактерии служат показателями фекальной загрязнённости почвы. Наличие в почве бактерий Streptococcus faecalis (стрептококков фекальных) или Escherihia coli (грамотрицательная кишечная палочка) говорит о свежем фекальном загрязнении. Присутствие таких микроорганизмов, как Clostridium perfringens (возбудитель токсикоинфекций), определяет давнее загрязнение.
Почву оценивают как «чистую» без ограничений по санитарно-бактериологическим показателям при отсутствии патогенных бактерий и индексе санитарно-показательных микроорганизмов до 10 клеток на грамм почвы. О возможности загрязнения почвы сальмонеллами свидетельствует индекс санитарно-показательных организмов (БГКП и энтерококков) 10 и более клеток/г почвы. Концентрация колифага в почве на уровне 10 БОЕ на г и более свидетельствует об инфицировании почвы энтеровирусами.
Из всех объектов окружающей среды почва наиболее часто и интенсивно загрязняется возбудителями кишечных паразитарных заболеваний (гельминтозы, лямблиоз, амебиаз и др). Почва для яиц геогельминтов (аскарид, власоглавов, токсокар, анкилостомид, стронгилоидес и др.) является неотъемлемой средой прохождения их биологического цикла развития и местом временного пребывания для яиц биогельминтов (описторхи, дифиллоботрииды, тенииды и др.), а также цист кишечных патогенных простейших (криптоспоридий, изоспор, лямблий, балантидий, дизентерийной амебы и др.).
Яйца геогельминтов сохраняют жизнеспособность в почве от 3 до 10 лет, биогельминтов — до 1 года, цисты кишечных патогенных простейших — от нескольких дней до 3-6 месяцев. Основными «поставщиками» (источниками) яиц гельминтов в окружающую среду являются больные люди, домашние и дикие животные, птицы. Массовое развитие яиц геогельминтов в почве происходит в весенне-летний и осенний сезоны, зависит от микроклиматических условий почвы: температуры, относительной влажности, содержания кислорода, освещенности солнцем и др. В зимний период они не развиваются, но сохраняются жизнеспособными на всех стадиях развития, особенно под снегом, и с наступлением теплых дней продолжают развитие.
При оценке эпидемической опасности и степени загрязнения почвы возбудителями паразитарных болезней определяют:
- вид возбудителей;
- их жизнеспособность и инвазионность;
- экстенсивный показатель загрязнения «А» — отношение числа положительных проб, в которых обнаружены возбудители паразитарных болезней, к общему числу исследованных проб в процентах;
- интенсивный показатель загрязнения — общее содержание возбудителей паразитарных болезней в 1 кг (или 100 г) почвы.
Санитарно-энтомологическими показателями являются личинки и куколки синантропных мух. Синантропные мухи (комнатные, домовые, мясные и др.) имеют важное эпидемиологическое значение как механические переносчики возбудителей ряда инфекционных и инвазионных болезней человека (цисты кишечных патогенных простейших, яйца гельминтов и др.).
Критерием оценки санитарно-энтомологического состояния почвы является отсутствие или наличие преимагинальных (личинки и куколки) форм синантропных мух на площадке размером 20х20 см. Наличие личинок и куколок в почве населенных мест является показателем неудовлетворительного санитарного состояния почвы и указывает на плохую очистку территории, неправильное хранение бытовых отходов и их несвоевременное удаление.
В санитарно-эпидемиологическом отношении почвы и грунты населенных мест могут быть разделены на следующие категории по уровню биологического загрязнения: чистая, умеренно опасная, опасная, чрезвычайно опасная. Вы можете заказать анализ почвы и грунтов в нашей лаборатории.
Оценка уровня биологического загрязнения почв и грунтов
| Категория загрязнения почв и грунтов | Индекс БГКП | Индекс энтеро-кокков | Патогенные бактерии, в т.ч. сальмонеллы | Яйца гельминтов, экз/кг | Личинки-Л куколки-К мух, экз. в почве с площадью 20 х 20 см |
| Чистая | 1-10 | 1-10 | — | 0 | 0 |
| Умеренно опасная | 10-100 | 10-100 | — | 1-10 | Л до 10 К — отс. |
| Опасная | 100-1000 | 100-1000 | — | 10-100 | Л до 100 К до 10 |
| Чрезвычайно опасная | 1000 и выше | 1000 и выше | — | 100 и выше | Л>100 К>10 |
Микробиологический анализ почвы
С помощью микробиологического анализа можно определить свойства почвы и степень ее безопасности в эпидемическом и гигиеническом отношении.
Почва – это среда, в которой находятся не только растения, но большое количество микроорганизмов. Их содержание определяет категорию состояния почвы в зависимости от степени ее загрязненности – чистая, умеренно опасная, опасная, чрезвычайно опасная.
Позвоните в нашу Лабораторию, и мы поможем узнать состав почвы возле Вашего дома или на участке и предотвратить негативные последствия!
Что оценивается с помощью микробиологического анализа почвы?
1. Индекс БГКП (Определение общих колиформных бактерий)
Оценка фекального заражениями, кишечные палочки (количество БГКП в1 г почвы).
Бактерии группы кишечной палочки включают следующие роды: эшерихия, клебсиелла, энтеробактер, цитробактер и серрации.
2. Индекс энтерококков
Энтерококки – грамположительные, не образующие каталазу кокки, слегка вытянутые, с заостренными концами, располагающиеся в виде диплококков или коротких цепочек, реже одиночными кокками. Это бактерии, которые могут провоцировать серьезные инфекции и как результат тяжелые заболевания, так как являются условно патогенными бактериями
3. Патогенные бактерии, в т.ч. сальмонеллы
Патогенные бактерии попадают в почву с выделениями человека и животных и сохраняющиеся в течение нескольких недель или месяцев. В эту группу входят различные споронеобразующие бактерии
4. Лактозоположительные кишечные палочки (индекс)
5. Нитрифицирующие бактерии
6. Общее численности сапрофитных микроорганизмов
7. Общее число споровых микроорганизмов

8. Термофильные бактерии
9. Показатели биологической активности почвы (ОМЧ)
Основные показатели: общая микробная численность (ОМЧ), определение актиномицетов, аммонификаторов, нитрификатов и др.
10. Аммонифицирующие микроорганизмы
11. Цисты
Цисты сохраняются в почве 8-10 и более лет. Передаются с клубнями, почвой, сельскохозяйственным инвентарем.
Паразитология Химия Плодородие Радиология Металлы Загрязнители
САНИТАРНО-МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ВОДЫ, ВОЗДУХА И ПОЧВЫ
Цель занятия.Ознакомить студентов с основными методами и показателями, необходимыми для санитарно-микробиологической оценки объектов внешней среды.
Оборудование и материалы. Прибор для подсчета колоний, колбы с пробами воды, бактериологические пробирки с 9 мл воды, пробирки с 10 мл расплавленного агара, мерные стерильные пипетки на 2 мл, стерильные чашки Петри, чашки Петри с МПА, чашки Петри с кровяным МПА, навески почвы, стерильная водопроводная вода в колбе — 270 мл, пробирки со средой Кесслера, Вильсона—Блера.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Для оценки санитарно-гигиенического состояния объектов окружающей среды проводят санитарно-бактериологические исследования, цель которых состоит в определении эпизоотологической и эпидемиологической безопасности. Показателем неблагополучия служит выявление патогенных микроорганизмов. Однако прямое их обнаружение связано с большими трудностями, и прежде всего с низкой концентрацией данных микробов, которые в основном не могут размножаться в воде, воздухе и почве. Поэтому в санитарно-микробиологической практике используют косвенные методы, направленные на определение микробной обсемененности объекта и обнаружение в нем так называемых санитарно-показательных бактерий. О бактериальной обсемененности судят по микробному числу — общему количеству микроорганизмов, содержащихся в единице объема или массы (1 мл воды, 1 г почвы, 1 м3 воздуха).
Содержание санитарно-показательных бактерий определяют по двум показателям: титру и индексу. Титром называют минимальный объем или массу, в которых выявляют данные бактерии, индексом — количество санитарно-показательных бактерий, содержащихся в соответствующем количестве среды.
К санитарно-показательным бактериям относят представителей облигатной микрофлоры организма человека и теплокровных животных, для которых среда обитания — кишечник или воздушно-дыхательные пути. Они характеризуются следующими свойствами: 1) постоянно выделяются с калом или капельками слизи из воздушно-дыхательных путей; 2) не имеют других мест обитания; 3) способны сохраняться в окружающей среде то же время, что и патогенные бактерии, паразитирующие в кишечнике или воздушно-дыхательных путях; 4) не способны интенсивно размножаться вне организма хозяина и изменять свои свойства.
Перечисленные признаки присущи бактериям, признанным санитарно-показательными для различных объектов окружающей среды.
Санитарно-показательные бактерии группы кишечных палочек принадлежат к различным родам семейства энтеробактерий.
Обнаружение кишечной палочки в разных объектах окружающей среды считают наиболее достоверным признаком свежего фекального загрязнения. Наличие в этих же объектах бактерий родов Citrobacter и Enterobacter указывает на относительно давнее фекальное загрязнение.
Присутствие С. perfringens, С. sporogenes и других клостридий в почве свидетельствует о ее фекальном загрязнении, причем как свежем, так и давнем, поскольку эти бактерии образуют споры, что позволяет им длительно переживать в окружающей среде (в частности, в почве).
Обнаружение в объектах окружающей среды Streptococcus faecalis также свидетельствует об их фекальном загрязнении. Резкое увеличение количества этих бактерий в саморазогревающемся навозе и компостах может свидетельствовать о загрязнении почвы разлагающимися отбросами.
Гемолитические стрептококки, будучи облигатными обитателями носоглотки и зева, выделяются с капельками слизи орально-капельным путем. Сроки выживания гемолитических стрептококков в окружающей среде практически не отличаются от сроков, характерных для большинства других возбудителей воздушно-капельных инфекций. Обнаружение гемолитических стрептококков в воздухе помещений указывает на возможное его загрязнение микроорганизмами, содержащимися в зеве, носоглотке, верхних дыхательных путях и вызывающими инфекции, передаваемые воздушно-капельным путем.
Staphylococcus aureus — также факультативный обитатель носоглотки и зева. Его присутствие в воздухе помещений служит показателем орально-капельного загрязнения.
Одновременное обнаружение золотистого стафилококка и гемолитических стрептококков свидетельствует о высокой степени загрязнения воздуха.
Санитарно-микробиологическое исследование воды. Вода — естественная среда обитания микробов, которые в большом количестве поступают из почвы, воздуха, с отбросами, стоками. Особенно много микроорганизмов в открытых водоемах и реках. Кроме сапрофитов в воде могут находиться возбудители инфекций животных и человека.
При контроле санитарного состояния воды исследованию подлежат: вода централизованного водоснабжения, колодцев, открытых водоемов (реки, озера), плавательных бассейнов, сточные жидкости.
Отбор проб воды. Из открытых водоемов пробы воды отбирают с глубины 10...15 см от поверхности и на расстоянии 10... 15 см от дна. Водопроводную воду набирают в стерильные флаконы объемом 0,5 л с притертой пробкой. Предварительно кран обжигают и спускают воду в течение 10... 15 мин. Хлорированную воду перед исследованием нейтрализуют тиосульфатом натрия из расчета 10 мл на 1л воды. Бактериологическое исследование проб воды следует проводить в течение двух часов после отбора или шести часов при температуре хранения 1...5°С.
Определение микробного числа воды. Водопроводную воду засевают в количестве 1мл, воду открытых водоемов — по 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10...12 мл расплавленного и охлажденного до 40...45 °С питательного агара, который тщательно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1...2сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 ºС в течение суток, другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл.
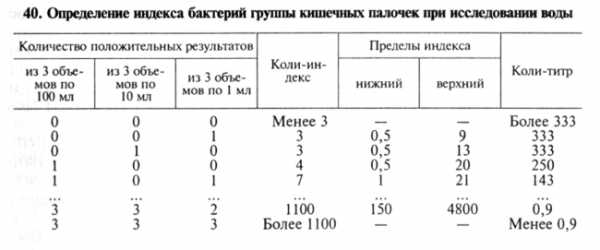
Определение коли-титра и коли-индекса воды. Минимальное количество воды в мл, в котором обнаруживают бактерии группы кишечных палочек (БГКП), называют коли-титром воды, количество БГКП, содержащихся в 1л исследуемой воды, называют кол и-и ндексом воды. Коли-титр и коли-индекс воды определяют титрационным (бродильным) методом или методом мембранных фильтров.
Титрационный метод. В глюкозо-пептонную среду (1%-я пептонная вода, 0,5%-й раствор хлорида натрия, 0,5%-й раствор глюкозы, индикатор Андреде и поплавок) проводят посевы различных объемов воды.
Воду открытых водоемов исследуют в объемах 100; 10; 1 и 0,1 мл. Для анализа водопроводной воды делают посевы трех объемов по 100 мл, трех объемов по 10 мл и трех объемов по 1 мл. Посевы инкубируют при 37 °С в течение суток. О брожении судят по образованию пузырьков газа в поплавке. Из забродивших или помутневших проб делают посевы на среду Эндо. Из выросших колоний готовят мазки, окрашивают по Граму и ставят оксидазный тест, с помощью которого дифференцируют бактерии родов Escherichia, Citrobacter и Enterobacter от грамотрицательных бактерий семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде. С этой целью 2...3 изолированные колонии наносят «штрихом» на фильтровальную бумагу, смоченную диметил-n-фенилендиамином. При отрицательном оксидазном тесте цвет бумаги не изменяется, при положительном она окрашивается в синий цвет в течение 1 мин. Грамотрицательные палочки, не образующие оксидазу, вновь исследуют в бродильном тесте — вносят в полужидкий питательный агар с 0,5 % глюкозы и инкубируют при 37 °С в течение суток. При положительном результате определяют коли-титр и коли-индекс по статистической таблице.
Метод мембранных фильтров. Определенный объем воды пропускают под давлением через мембранный фильтр № 3, предварительно стерилизованный кипячением в дистиллированной воде. Водопроводную воду и воду артезианских скважин фильтруют в объеме 333 мл. Чистую воду открытых водоемов фильтруют в объеме 100, 10, 1 и 0,1 мл, более загрязненную воду перед фильтрованием разводят стерильной водой. Фильтры накладывают на агар Эндо в чашки Петри и после инкубации при 37 °С в течение суток подсчитывают количество выросших красных колоний. Из двух-трех колоний делают мазки, окрашивают их по Граму и ставят оксидазный тест. Грамотрицательные палочки, не образующие оксидазу, принадлежат к БГКП. По существующим нормативам (ГОСТ 2874—82) питьевую воду считают качественной, если ее коли-индекс не более 3, а микробное число — не более 100.
Общепринятым дополнительным показателем фекального загрязнения воды служит количество S.faecalis. Для определения его титра цельную воду и ее 10-кратные разведения засевают в жидкую элективную среду (щелочная полимиксиновая среда). После инкубирования при 37 ºС в течение двух суток, а затем еще через сутки и двое суток делают высевы на плотные элективные среды. Фекальные стрептококки идентифицируют по морфологическим, культуральным и тинкториальным свойствам.
Есть данные о корреляции между содержанием в воде фекальных кишечных палочек и фагами бактерий группы кишечных палочек. Поэтому определение данных фагов служит косвенным показателем возможного присутствия кишечных палочек в исследуемой пробе воды.
Санитарно-микробиологическое исследование воздуха. Микрофлора воздуха зависит от микрофлоры почвы и воды. Воздух — неблагоприятная среда для обитания микроорганизмов из-за отсутствия питательных веществ, действия солнечных лучей, высушивания. Наряду с сапрофитами в воздухе могут находиться патогенные бактерии, споры грибов родов Aspergillus, Mucor и др.
Санитарную оценку воздуха осуществляют по двум показателям: 1) определение микробного числа воздуха; 2) определение количества санитарно-показательных бактерий — гемолитических стрептококков и стафилококков.
Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации.
Седиментационный метод осаждения Коха. Чашки Петри с МПА оставляют открытыми на 5...10 мин. Для определения санитарно-показательных бактерий берут чашки Петри с кровяным МПА и время экспозиции увеличивают до 40 мин. Чашки выдерживают при 37 °С и комнатной температуре 24 ч и подсчитывают выросшие колонии.
Микробное число воздуха (общее количество бактерий в 1 м3) определяют по формуле Омелянского
Х= а * 100 * 1000 * 5 / (b * 10 * T),
где X— количество микробов в 1 м3 (1000 л) воздуха; а — количество выросших колоний в чашках; b — площадь чашки; Т— время, в течение которого чашка была открыта; 5 — время по правилу Омелянского; 10 — объем воздуха в литрах. (Правило Омелянского предусматривает, что на поверхности агара в чашке Петри площадью 100 см3 за 5 мин из воздуха оседает такое количество микробов, которое находится в его 10 л.)
Прямое обнаружение патогенных микробов воздуха проводят только при специальных показаниях.

Аспирационный метод. Более точный количественный способ определения микробного числа воздуха, так как посев микроорганизмов из воздуха производят с помощью приборов. При использовании аппарата Кротова воздух с заданной скоростью засасывается через щель плексигласовой пластины и ударяется о поверхность питательной среды открытой чашки Петри, находящейся на вращающейся подставке, благодаря чему происходит равномерный посев бактерий из воздуха на поверхность МПА (при определении микробного числа) или кровяного МПА (при выделении гемолитических стафилококков и стрептококков). После инкубации в термостате в течение двух суток подсчитывают количество выросших колоний и определяют микробное число воздуха. При исследовании воздуха могут быть использованы и другие приборы (Дьякова, Киктенко, ПАБ-1 — прибор аэрозольный бактериологический и ПОВ-1 — прибор для отбора воздуха). В практику входят ускоренные методы индикации микрофлоры воздуха с помощью мембранных фильтров, каскадных им-пакторов, фильтров Петрякова и др.
Санитарно-микробиологическое исследование почвы. Анализ почвы включает в себя определение микробного числа, коли-тит-ра, перфрингенс-титра и титра термофильных бактерий. По эпидемиологическим признакам проводят определение в почве патогенных микроорганизмов: сальмонелл, шигелл, возбудителей столбняка, ботулизма, злокачественного отека, сибирской язвы. Бактериологический анализ почвы нужен при выборе территории под пастбище, ферму, хозяйственные постройки, детские сады, больницы и др.
Предварительно делают отбор проб почвы. На обследуемой территории площадью до 1000 м3 выделяют два участка по 25 м3 (один — вблизи источника загрязнения, другой — в отдалении от него), берут пробы из 5 точек (4 — по углам участка, 1 — в центре) на глубине 10...20 см стерильным совком (из более глубоких мест — с помощью специального бура Некрасова или Френкеля). Пробы почвы по 200...300 г отбирают в широкогорлые стеклянные банки с ватными пробками (можно все взятые с одного участка пробы перемешать и на исследование направить 1 кг). На банки наклеивают этикетки, отправляют с нарочным и сопроводительным письмом. Пробы почвы полагается исследовать сразу же или в течение 6... 18 ч, сохраняя их при температуре не выше 1...5ºС.
В лаборатории почву измельчают, освобождают от камней, осколков стекол, корней растений, просеивают через сито, тщательно перемешивают и отвешивают 30 г. В колбу на 500 мл наливают 270 мл стерильной водопроводной воды и вносят в нее отвешенную пробу почвы, все интенсивно встряхивают 10 мин, не давая отстояться частицам суспензии, готовят серию десятикратных последовательных разведений. Для относительно чистых почв достаточно 4 степени разведения, для загрязненных — 6...9 разведений. В штатив ставят нумерованные пробирки с 9 мл стерильной воды в каждой. В первую вносят 1 мл суспензии пробы почвы, смешивают, затем 1 мл из первой пробирки вносят во вторую, смешивают, из нее — 1 мл в третью и т. д. В результате в пробирке № 1 получается разведение 1 : 100, № 2 — 1 : 1000 и т.д. Подготовленные таким образом пробы почвы исследуют.
Определение общего микробного числа. Из последних 3...4 пробирок с разведенной суспензией отдельными стерильными пипетками вносят по 1 мл в стерильные чашки Петри (каждое разведение в отдельности). В каждую чашку добавляют еще по 10... 15 мл расплавленного и охлажденного до 45 ºС МПА. Равномерными осторожными круговыми движениями содержимое чашек перемешивают, оставляют на столе для уплотнения (затвердения) агара. С застывшей средой чашки перевертывают вверх дном, надписывают и помещают в термостат для культивирования на 24...48 ч при 37 °С. Выросшие колонии подсчитывают в каждой чашке, умножают на степень разведения, полученные числа суммируют и вычисляют среднеарифметическое число, что составит количество микробов, содержащихся в 1 г почвы.
Определение коли-титра, перфрингенс-титра и титра термофильных бактерий почвы. Для определения коли-титра почвы различные разведения почвенной взвеси засевают по 1 мл в пробирки со средой Кесслера (на 1л дистиллированной воды — 10г пептона, 50 мл бычьей желчи — 2,5 г лактозы, 4 мл 1%-го водного раствора генцианвиолета) и инкубируют при 43 ºС в течение 48 ч. В дальнейшем исследования проводят по схеме, применяемой при определении коли-титра воды. Наибольшее разведение почвенной суспензии, в котором отмечена ферментация лактозы (газообразование), соответствует коли-титру почвы. Для определения перфрингенс-титра почвы различные разведения почвенной суспензии по 1 мл засевают в пробирки со стерильным обезжиренным молоком или железосульфитной средой Вильсона— Блера, приготовленной ex tempore. Посевы инкубируют при 43 °С в течение 24...48 ч, после чего учитывают результаты по свертыванию молока или по образованию черных колоний С. perfringens в агаровом столбике среды Вильсона—Блера. Из колоний делают мазки, окрашивают по Граму, микроскопируют и вычисляют перфрингенс-титр, который соответствует наибольшему разведению почвы, вызвавшему почернение и разрыв среды Вильсона— Блера в первые 12 ч роста.
Для определения титра термофильных бактерий разведения почвенной суспензии по 1 мл вносят в чашки Петри, заливают расплавленным и охлажденным агаром. Посевы инкубируют в течение суток при 60 ºС, а затем подсчитывают количество выросших колоний и пересчитывают на 1 г почвы.
Санитарно-микробиологическую оценку почвы проводят по комплексу показателей, из которых наиболее важный ление степени фекального загрязнения.
[1]Пептон — промежуточный продукт распада белков, состоящий из полипептидов и аминокислот; готовят из сычугов крупного рогатого скота и желудков свиней; выпускают в виде порошка, хорошо растворимого в воде.
Дата добавления: 2016-07-22; просмотров: 1343; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Похожие статьи:
17.2. Санитарно-микробиологическое исследование почвы
Почва является естественной средой обитания микроорганизмов. В ней имеются все условия для благоприятного их развития (достаточное количество влаги, органических и минеральных веществ). Из природных субстратов почва обильно заселена микроорганизмами, которые составляют ее постоянную микрофлору. Санитарно-гигиеническая роль этой микрофлоры огромна. Почвенные микроорганизмы участвуют в минерализации органических отбросов, самоочищении почвы, в круговороте веществ в природе.
В почву могут попадать патогенные микроорганизмы со сточными водами, с трупами людей и животных. В связи с этим почва может служить источником распространения возбудителей инфекционных болезней, через почву загрязняются объекты окружающей среды, может происходить обсеменение сапрофитными и болезнетворными микроорганизмами сырья, пищевых продуктов, кормов.
Количественный и видовой состав микроорганизмов в почве обусловлен содержанием в ней органических веществ, влаги, рН, температурой, климатическими условиями и т.д.
В составе микрофлоры почвы принято выделять так называемые физиологические группы микроорганизмов, которые участвуют в различных процессах и на разных этапах постепенного разложения органических веществ, к которым относятся:
1. Аммонофикаторы (гнилостные).
2. Нитрифицирующие бактерии.
3. Азотофиксирующие.
4. Бактерии, расщепляющие клетчатку, а также вызывающие различные брожения (молочнокислое, спиртовое, маслянокислое и др.)
5. Бактерии, участвующие в круговороте серы, железа, фосфора других элементов.
В почве могут быть и патогенные бактерии, продолжительность их выживаемости зависит от вида и условий внешней среды.
Неспорообразующие патогенные бактерии и вирусы погибают в ней в течение нескольких суток или месяцев, в частности, возбудитель туберкулеза в почве сохраняется до 1 года.
Особое место занимают возбудители почвенных инфекций (сибирской язвы, эмфизематозного карбункула, столбняка, ботулизма), которые образуют споры и сохраняются в почве годами, а возбудитель сибирской язвы – десятки лет.
Краткий санитарно-бактериологический анализ почвы включает определение двух показателей: общего количества микробов (в 1 г почвы) и коли-титра.
В отдельных случаях в почве определяют возбудителей сибирской язвы, столбняка, ботулизма.
Отбор проб почвы. На обследуемой территории до 1000 м выделяют два участка по 25 м2 каждый: один участок выбирают вблизи, другой – вдали от источника загрязнения. С каждого участка отбирают среднюю пробу, составленную из 5 образцов, взятых по диагонали или в четырех точках по краям и в одной в центре. Образцы берут на глубине до 20 см, при исследовании почвы скотомогильников – ниже глубины захоронения не менее чем на 25 см, Пробы отбирают стерильной железной лопаткой, совком или специальным буром в стерильные широкогорлые банки, которые закрывают ватными пробками. К банке приклеивают этикетку с датой и номером отобранной почвы.
Масса каждого образца должна быть 200-300 г, а смешанного – не менее 1 кг. Отобранные пробы почвы направляют в лабораторию и исследуют сразу же или не позднее чем через 12-18 ч при хранении при 1-5 °С.
В колбу на 500 мл, наливают 270 мл стерильной водопроводной воды и вносят 30 г исследуемой почвы. Колбу с содержимым встряхивают в течение 10 мин. Из полученного разведения почвы 1:10-1 готовят десятикратные разведения: для чистых почв 1:10-2 до 1:10-4, для загрязненных – до 1:10-6 и больше.
Определение общего микробного числа (ОМЧ)
Из последних 3-4 пробирок приготовленных разведений берут 1 мл и переносят в стерильные чашки Петри (не менее двух чашек на каждое разведение). В эти чашки заливают по 10 мл расплавленного и охлажденного до 45°С МПА и тщательно перемешивают. Посевы культивируют в термостате при 37°С 24-48 ч.
Учет результатов проводят путем подсчета выросших колоний и определения среднеарифметического числа. Полученное число колоний умножают на степень разведения исследуемой почвы, получая число бактерий в 1 г почвы.
Определение коли-титра почвы методом бродильных проб с использованием среды Кесслера. Исследования проводят в три этапа. На первом этапе готовят разведения: для чистых почв от 1:10-1 до 1:10-3: для загрязненных – от 1:10-3 до 1:10-6 . После тщательного перемешивания 1 мл полученной суспензии из различных разведений переносят в пробирку с 9 мл среды Кесслера (на 1 л дистиллированной воды 10 г пептона, 50 мл бычьей желчи, 2,5 г лактозы, 4 мл 1%-ного водного раствора генцианвиолета). Посевы культивируют при 43°С в течение 48 часов.
На втором этапе исследования просматривают посевы на среде Кесслера. Из пробирок с наличием газа продолжают высев на среду Эндо. Посевы культивируют при 37°С в течение 24 ч.
На третьем этапе исследуют колонии, выросшие на среде Эндо. Отбирают колонии, типичные для бактерий группы кишечных палочек, готовят из них мазки, красят по Граму, микроскопируют. При обнаружении в мазках коротких полиморфных грамотрицательных палочек производят высев из этих колоний на среду Кесслера для подтверждения газообразования в чистой культуре.
Таблица 3







